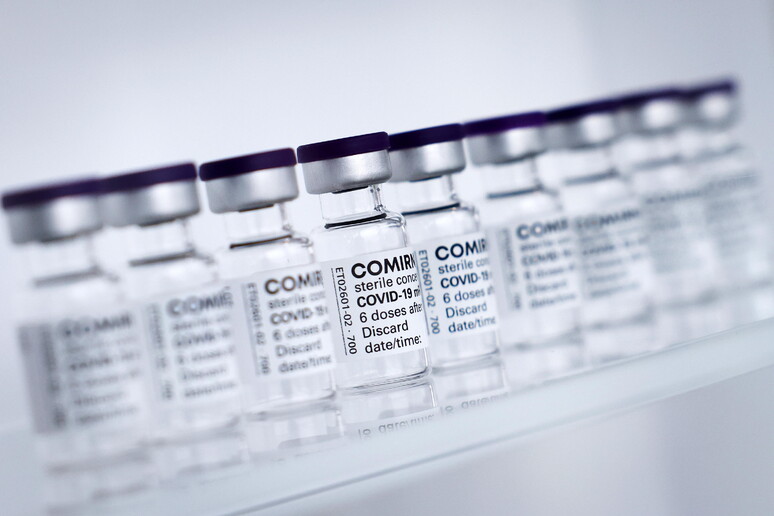
BRUXELLES - "La Commissione europea ha approvato l'utilizzo del vaccino Covid di BioNTech Pfizer, per la fascia d'età tra i 12 ed i 15 anni. Gli Stati membri possono ora decidere di estendere la loro campagna vaccinale ai più giovani. Per mettere fine alla crisi, ogni dose conta". Così la commissaria europea alla Salute, Stella Kiyriakides, su Twitter dopo il via libera dell'Agenzia europea del farmaco (Ema).
"Starà a ciascun Stato membro se e quando usare il vaccino di Pfizer-BionTech per gli adolescenti. L'uso raccomandato per gli adolescenti seguirà la linea adottata per gli adulti, ovvero due dosi, con un intervallo di almeno 3 settimane", aveva spiegato Marco Cavaleri dell'Ema.
Lo studio, ha detto l'Ema, ha dimostrato che la risposta immunitaria a Comirnaty in questo gruppo era paragonabile alla risposta immunitaria nella fascia di età compresa tra 16 e 25 anni. L'efficacia di Comirnaty è stata calcolata in quasi 2.000 bambini di età compresa tra 12 e 15 anni che non presentavano segni di infezione precedente. Questi hanno ricevuto il vaccino o un placebo, senza sapere quale era stato somministrato. Dei 1.005 bambini che hanno ricevuto il vaccino, nessuno ha sviluppato il Covid rispetto a 16 bambini su 978 che hanno ricevuto l'iniezione fittizia. Ciò significa che, in questo studio, il vaccino è stato efficace al 100% nel prevenire il virus (sebbene il tasso reale potrebbe essere compreso tra il 75% e il 100%).
Gli effetti indesiderati più comuni nei bambini di età compresa tra 12 e 15 anni sono simili a quelli nelle persone di età pari o superiore a 16 anni. Includono dolore al sito di iniezione, stanchezza, mal di testa, dolori muscolari e articolari, brividi e febbre. Questi effetti sono generalmente lievi o moderati e migliorano entro pochi giorni dalla vaccinazione. L'Ema ha concluso che i benefici del siero in questa fascia di età superano i rischi. Tuttavia è stato osservato che, a causa del numero limitato di bambini inclusi nello studio, questo non avrebbe potuto rilevare effetti collaterali rari.
Il comitato per la sicurezza dell'Ema sta attualmente valutando casi molto rari di miocardite (infiammazione del muscolo cardiaco) e pericardite (infiammazione della membrana intorno al cuore) che si sono verificati dopo la vaccinazione con Pfizer, principalmente in persone di età inferiore a 30 anni. Attualmente non vi è alcuna indicazione che questi casi siano dovuti al vaccino e l'Ema sta monitorando attentamente questa questione. Nonostante questa incertezza, l'Ema ha ritenuto che i benefici del siero Pfizer nei bambini di età compresa tra 12 e 15 anni siano superiori ai rischi, in particolare nei bambini con condizioni che aumentano il rischio grave di Covid-19. La sicurezza e l'efficacia del vaccino sia nei bambini che negli adulti continueranno a essere monitorate attentamente.
"La possibilità di mischiare i vaccini anti Covid è una questione importante attualmente in discussione. Ci sono due studi clinici che forniscono dati sul mix, in particolare tra AstraZeneca e vaccini mRna, uno condotto nel Regno Unito e l'altro in Spagna. Dai primi dati vediamo non ci sono grosse preoccupazioni con tale approccio da un punto di vista della sicurezza e dell'efficacia. Tuttavia raccoglieremo ulteriori dati e li studieremo per essere sicuri che questo approccio è buono come sembra".
Riproduzione riservata © Copyright ANSA